同学们运用对比的学习方法探究碱的性质。
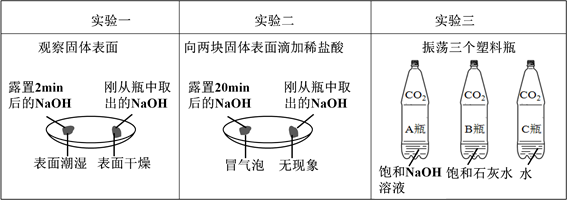
(1)由上图实验一、二可知,氢氧化钠会吸收空气的 ,因此要密封保存。
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C, A瓶内发生反应的化学方程式为 ,对比A瓶与 (选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应。
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙溶液(分别编号为A、B)。
| 方案一 | 方案二 | 分析 |
| 微热(不考虑水分蒸发) | 两种方案中均观察到A试管内出现白色浑浊,A中试剂为 ; 方案二的设计原理是利用了 。 |
(4)同学们看到盛有NaOH的试剂瓶上标注着“NaOH含量不少于96.0%”,开始如下探究:
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是:2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑,
2NaOH + H2↑ + Cl2↑,
然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为碳酸钠和氯化钠。
【实验探究】取样溶于水,并分成两份。
步骤①:向一份溶液中滴加酚酞试剂;
步骤②:向另一份溶液中滴加过量稀硝酸;
步骤③:向②所得溶液中继续滴加硝酸银溶液。
【实验结论】猜想正确。
请分析:
Ⅰ.步骤①中可观察到液体变 色;
Ⅱ.步骤②所得溶液中的溶质除NaCl外,还有 ;
Ⅲ.写出步骤③中发生反应的化学方程式 ;
Ⅳ.上述实验中步骤 (填写序号)是没有必要进行的。
(1)H2O、CO2
(2)CO2 +2NaOH →Na2CO3 + H2O,C
(3)氢氧化钙溶液,氢氧化钙的溶解度随温度升高而减少,氢氧化钠的溶解度随温度升高而升高
(4)红,NaNO3、HNO3,NaCl+AgNO3→AgCl↓ +NaNO3,①。
题目分析:(1)由上图实验一、二可知,氢氧化钠会吸收空气的水分散潮解,与二氧化碳反应生成碳酸钠而变质,因此要密封保存;
②三个软塑料瓶变瘪的程度大小为A>B>C,即氢氧化钠吸收的二氧化碳的最多,水吸收二氧化碳的最少;
③方案一生成白色沉淀是由于氢氧化钙与碳酸钠反应生成的,方案二是由于氢氧化钙的溶解度随温度的升高而减小的原理;
④氢氧化钠溶液呈碱性,能使无数酚酞变红,由于可以肯定的氢氧化钠溶液,故该步骤没有必要;氢氧化钠能与稀硝酸反应生成硝酸钠;若含有氯化钠,则会与硝酸银反应生成氯化银沉淀:NaCl+AgNO3→AgCl↓ +NaNO3
