某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4•5H2O;然后再分别滴入几滴浓硫酸,观察现象.回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变______(填实验现象),说明浓硫酸具有______性.
(2)浓硫酸滴入CuSO4•5H2O中,胆矾______(填实验现象),说明浓硫酸具有______性.
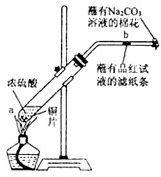
实验二:如图所示进行实验:玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花.给试管加热,观察现象.一段时间以后,停止加热.
回答下列问题:
(3)写出a处反应的化学方程式______.
(4)试管中的液体反应一段时间后,b处滤纸条的变化是______.
(5)写出C处Na2CO3的作用______,有关的化学反应方程式______.
(1)浓硫酸滴入小纸片上,小纸片变成黑色,体现了浓硫酸的脱水性,
故答案为:黑;脱水性;
(2)浓硫酸滴入CuSO4•5H2O中,胆矾中的水分会被浓硫酸吸出,胆矾由蓝色变成白色,浓硫酸表现了吸水性,
故答案为:由蓝色变成白色;吸水性;
(3)试管中,铜与浓硫酸在加热条件下能够反应生成二氧化硫、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,△ .
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;△ .
(4)铜与浓硫酸反应生成的二氧化硫具有漂白性,所以试管中的液体反应一段时间后,b处滤纸条变白,
故答案为:滤纸变白;
(5)二氧化硫有毒,不能直接排放到大气中,由于碳酸钠溶液能够与二氧化硫反应生成无毒的二氧化碳,可以使用碳酸钠溶液吸收多余的二氧化硫,反应的化学方程式为:Na2CO3+SO2=Na2SO3+CO2 ,
故答案为:吸收二氧化硫,防止污染;Na2CO3+SO2=Na2SO3+CO2 .
