用含一定杂质的高锰酸钾样品8.78g,加热使之完全反应(杂质不反应),制取了0.56L氧气(标 准状况下氧气的密度为1.429g/L),试计算:
(1)该高锰酸钾样品的纯度是多少?
(2)反应后试管里剩余什么物质?各多少g?
解:0.56L氧气的质量为0.56L×1.429L/g=0.8g
设高锰酸钾样品中含KMnO4的质量为x,生成的K2MnO4和MnO2的质量分别为y, z
2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
316 197 87 32
x y z 0.8g
316:32=x:0.8g
x=7.9g
197:32=y:0.8g
y= 4.925g≈ 4.9g
87:32=z:0.8g
z=2.175g ≈2.2g
样品的纯度是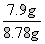 ×100%=90%,
×100%=90%,
样品中含杂质为8.78g-7.9g=0.88g
答:样品的纯度是90%,反应后试管里的剩余物质是锰酸钾4.9g,二氧化锰2.2g,杂质0.88g 。
