问题
问答题
某校化学小组的同学用如图装置对铜与浓硫酸在一定条件下的反应进行实验探究,请回答:

(1)写出A试管中发生反应的化学方程式______;若有1摩铜完全反应,则被还原的H2SO4的物质的量为______.
(2)请填写表中空白:
| B中棉花的位置 | ① | ② | ③ |
| 所蘸试剂 | 滴有酚酞的NaOH试液 | 品红溶液 | 淀粉和碘水混合液 |
| 现象 | ______ | ______ | ______ |
| 体现SO2的性质 | ______ | ______ | ______ |
(4)在C方框内画出吸收尾气的装置图,并标出试剂名称.
答案
(1)A试管中发生反应是铜和浓硫酸的反应,反应方程式是:Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O,△ .
根据反应方程式,1摩铜完全反应被还原的浓硫酸是1mol,
故答案为:Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O;1mol;△ .
(2)①二氧化硫通过滴有酚酞的NaOH试液,溶液红色消失,体现了二氧化硫的酸性,
故答案为:溶液红色消失;酸性;
②二氧化硫通过品红溶液,品红褪色,体现了二氧化硫的漂白性,
故答案为:品红褪色;漂白性;
③二氧化硫通过淀粉和碘水混合液,二氧化硫被碘氧化,蓝色褪色,体现了二氧化硫的还原性,
故答案为:蓝色褪色;还原性;
(3)二氧化硫和碘反应的离子方程式是:SO2+I2+2H2O=4H++2I-+SO42-,
故答案为:SO2+I2+2H2O=4H++2I-+SO42-;
(4)使用氢氧化钠溶液吸收多余的二氧化硫,故答案为: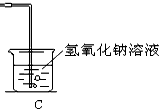 .
.
