(6分)在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成以下函数图像。
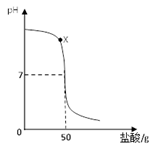
⑴ 用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有 。(填化学式)
⑵ 为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”。
。
⑶ 当pH=7时,求溶液中溶质的质量分数。
(1)NaCl NaOH
(2)氢氧化钠固体溶于水时也会产生热量,这样就无法说明热量来自于中和反应了
(3)13%
题目分析:(1)当溶液处于X点时,PH大于7,说明氢氧化钠过量,所以此时溶液中的溶质是NaCl 和NaOH,所以用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有:NaCl和NaOH
(2)服氢氧化钠固体溶于水时也会产生热量,这样就无法说明热量来自于中和反应了,所以不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”
(3)从图中可知,当pH=7时,表示反应恰好完全,根据反应:NaOH+HCl==NaCl+H2O中NaOH与NaCl的质量关系,可求出溶质NaCl的质量,
解:设溶质NaCl的质量为x
NaOH+HCl==NaCl+H2O
40 58.5
40g×20% x
40:58.5=40g×20%:x
X=11.7g
∴溶液中溶质的质量分数=11.7g/40g+50g×100%=13%
