把MgCl2、AlCl3两种固体组成的混合物溶于足量的水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量和生成沉淀的质量如下图所示。已知:NaOH与AlCl3反应时,先使AlCl3全部转化为不溶于水的Al(OH)3,然后Al(OH)3还能继续与过量的NaOH发生如下反应:Al(OH)3+NaOH====NaAlO2+2H2O,其中NaAlO2 是可溶于水的物质,试回答:
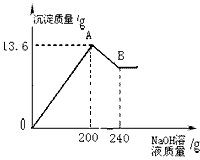
(1)A点的沉淀物的化学式有 ; B点的沉淀物的化学式是 ;
(2)原混合物中MgCl2、AlCl3的质量各为多少克?
解:
(1)Mg(OH)2、Al(OH)3; Mg(OH)2
(2)Al(OH)3 + NaOH = NaAlO2 + 2H2O
78 40
x 40g×10%
x = 7.8g
AlCl3 + 3NaOH = Al(OH)3↓+ 3NaCl
133.5 78
y 7.8g
y = 13.35g
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl
95 58
z 13.6g-7.8g
z = 9.5g
答:AlCl3为13.35g,MgCl2为9.5g
