(7分)已知:常温下,CO2、水都能与过氧化钠(化学式 Na2O2)反应产生 O2,其中CO2 与 Na2O2 反应的化学方程式为 2CO2 + 2Na2O2 =2Na2CO3 +O2。某校化学活动小组为探究 CO2与Na2O2反应的产物的性质,设计了如下图所示的实验装置。
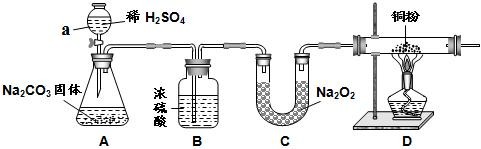
⑴仪器 a 的名称是: 。
⑵装置 B 的作用是 。
⑶装置 A 中,发生反应的化学方程式 。
⑷装置 D 玻璃管中,可以观察到的现象是 ,该反应的化学方程式为 。
⑸反应后,将装置 C 中的固体物质溶于水配成溶液,然后向该溶液中加入 (选填“盐酸”、“CaCl2 溶液”、“石蕊试液”之一),会出现 的现象。
⑹反应完毕后,测得装置 C 的总质量增加了 14g,则产生 O2 的质量为 g。
⑴ 分液漏斗 ⑹ 8
⑵ 除去CO2中的水蒸气(或干燥CO2)
⑶ Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
⑷ 红色粉末逐渐变黑 2Cu + O2 △ 2CuO
⑸ 盐酸 / CaCl2溶液/ 石蕊试液 无色气泡 / 白色沉淀 / 溶液变蓝
题目分析:(2)浓硫酸具有吸水性,能做干燥剂;
(3)碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳:Na2CO3+ H2SO4 = Na2SO4 + H2O + CO2 ↑;
(4)过氧化钠与二氧化碳反应生成的氧气与铜反应会生成氧化铜,故现象是红色的粉末变成黑色:
2Cu + O2 △ 2CuO;
(5)过氧化钠与二氧化碳反应生成的是氧气和碳酸钠,那么C 中的固体物质是碳酸钠固体,加盐酸会生成二氧化碳气体,加氯化钙会生成碳酸钙沉淀,由于碳酸钠溶液呈碱性,若加紫色石蕊试液石蕊会变成蓝色;
(6)装置 C中发生反应的化学方程式为:2CO2 + 2Na2O2 =2Na2CO3 +O2,装置 C 的总质量增加了 14g,利用差量法,那么生成氧气的质量为8g。
