问题
计算题
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取10.0g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时共用去49.0 g稀硫酸,还剩余固体3.5 g。试计算:(精确到0.1%)
⑴ 该黄铜中铜的质量分数为多少?
⑵ 稀硫酸溶质的质量分数是多少?
答案
解:⑴ 铜的质量分数: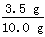 ×100%=35.0%
×100%=35.0%
⑵ 设所用稀硫酸溶质的质量为x
10.0g-3.5g=6.5g
Zn + H2SO4===ZnSO4 + H2↑
65 98
6.5 g x
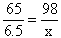 x =9.8g
x =9.8g
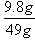 ×100%=20.0%
×100%=20.0%
答:黄铜中铜的质量分数是35.0%,稀硫酸溶质的质量分数是20.0%。
