问题
计算题
取一只烧杯,称得其质量为70.4g,加入一定量生铁样品碎屑,称得烧杯和样品的总质量为102.4g;向盛有生铁样品的烧杯中加入稀硫酸,边加边搅拌,直到烧杯中不再产生气泡,再加入少量稀硫酸以确保过量,测得共用去稀硫酸247.3g;静置,称量,称得烧杯和剩余物质的总质量为348.7g。
(1)实验过程中稀硫酸要过量的原因是 。
(2)计算该生铁样品中单质铁的质量分数。(请写出计算过程)
答案
(1)确保生铁样品中铁单质与稀硫酸完全反应
(2)解:生成H2的质量:102.4g + 247.3g - 348.7g = 1.0 g
设生铁样品中含铁的质量为x
Fe + H2SO4===FeSO4 + H2↑
56 2
x 1.0 g
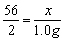 x = 28.0 g
x = 28.0 g
生铁样品中铁单质的质量分数为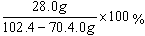 = 87.5%
= 87.5%
答:生铁样品中单质铁的质量分数是87.5%
