问题
计算题
为测定某厂生产的“高钙片” 样品中碳酸钙的质量分数,进行了以下实验:取11.0g样品放入烧杯中,称得烧杯及所盛样品的总质量为158.0g,再把100g稀盐酸平均分成四份依次加入样品中,每次均充分反应(已知样品中其它杂质不与盐酸反应)。实验数据记录如下:
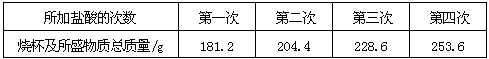
请你据此计算:
(1)第一次生成二氧化碳的质量是 g。
(2)“高钙片” 样品中碳酸钙的质量分数是多少?(结果精确到0.1%)
答案
(1)1.8;
(2)解:样品完全反应产生CO2质量:(158.0g+100g)-253.6g=4.4g
设11.0g样品中碳酸钙质量为X。则:
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
X 4.4g
100:44=X:4.4g
X=(100×4.4g)÷44=10g
则“高钙片”样品中碳酸钙的质量分数: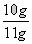 ×100%≈90.9%
×100%≈90.9%
答:“高钙片”样品中碳酸钙的质量分数是为90.9%。
