问题
计算题
为了测定某地石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行如下实验:(请写出详细的计算过程)
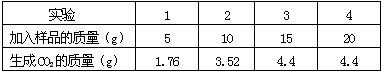
⑴ 计算这种石灰石样品中碳酸钙的质量分数。
⑵ 计算出实验所用稀盐酸中HCl的质量分数。
答案
解:⑴设5g石灰石中所含CaCO3质量为x
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 1.76 g (用3.52 g计算也可以)
100︰44=x︰1.76 g
x=4g
4 g/5 g×100%=80%
⑵50 g稀盐酸中所含溶质的质量为y
CaCO3+2HCl===CaCl2+H2O+CO2↑
73 44
y 4.4 g
73:44=y:4.4 g
y=7.3 g
7.3 g/50 g×100%=14.6%
答:⑴ 石灰石样品中碳酸钙的质量分数为80%;
⑵ 实验所用的稀盐酸的溶质质量分数为14.6%。
