问题
计算题
在某温度下,将36.5gCaCl2和NaCl的混合物放入236g水中使其完全溶解,再加入132.5g溶质质量分数为20%的Na2CO3溶液,恰好完全反应。(CaCl2+Na2CO3===CaCO3↓+2NaCl)试计算:
(1)生成CaCO3沉淀的质量是多少g? (计算结果保留一位小数)
(2)反应后所得溶液的溶质质量分数是多少g?
答案
解:设生成CaCO3沉淀的质量是x
Na2CO3+CaCl2===CaCO3↓+2NaCl
106 100
132.5g×20% x
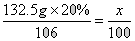 x=25g
x=25g
根据质量守恒定律,反应后溶液质量为: 36.5g+236g+132.5g-25g=380g
反应后溶液中溶质质量为:380g-[236g+132.5g×(1-20%)]=38g
反应后溶液中溶质质量分数为: ×100%=10%
×100%=10%



