问题
计算题
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数。现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应,消耗稀盐酸73g(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数。(反应的化学方程式为:Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+
3H2O)
答案
解:依题意,生成CO2的质量为:73g+15g-85.8g=2.2g
设铜矿中碱式碳酸铜的质量为x,生成氯化铜质量为y
Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O
222 270 44
x y 2.2g
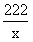 =
= x=11.1g
x=11.1g
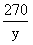 =
=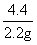 y=13.5g
y=13.5g
(1)铜矿中碱式碳酸铜的质量分数为: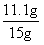 ×100%=74%
×100%=74%
(2)所得溶液中溶质的质量分数为: ×100%=16.5%
×100%=16.5%
答:铜矿中碱式碳酸铜的质量分数为74%,所得溶液中溶质的质量分数为16.5%
