问题
实验题
(16分)某化学兴趣小组利用饱和氯水与石灰石的反应,制取较浓的HClO溶液,并对所得溶液中的部分阴离子进行检验。
| 实验操作 | 实验现象 | |
| 步骤1 | 在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,过滤,将滤液分为若干份 | 有少量气泡产生,溶液的黄绿色褪去 |
| 步骤2 | 将第一份滤液与稀盐酸混合 | 产生大量气泡 |
| 步骤3 | 将第二份滤液加热 | 溶液变浑浊,且有大量无色气体产生 |
 1中发生反应的离子方程式是____________________________________,
1中发生反应的离子方程式是____________________________________,过滤的目的是____________________________________________________。
⑵步骤2、步骤3的实验目的都是_____________________________,为达到该实验目的,还可以采取的方法是______________________________________。
⑶步骤3中反应的离子方程式是: 。
(4)请你设计一个简单的实验方案,证明步骤1所得滤液中的HClO浓度比饱和氯水中HClO浓度大:_____________________________________________________。
答案
⑴ CaCO3+2H+=Ca2++H2O+CO2↑(3分)除去碳酸钙等不溶性杂质(2分)
⑵检验HCO3—离子(2分) 另取一份滤液,加入NaOH溶液,观察有无沉淀产生(3分)
⑶Ca2++2HCO3-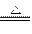 CaCO3↓+H2O+CO2↑(3分)
CaCO3↓+H2O+CO2↑(3分)
(4)同时将滤液和饱和氯水滴在有色布条上,比较有色布条褪色的快慢(3分)
