问题
计算题
某校兴趣小组探究学校附近赤铁矿中Fe2O3的纯度。他们采集了80g矿样,粉碎后均分成四等份,分别置于四个烧杯中,然后分别向四个烧杯中加入同一浓度的稀硫酸,加入硫酸的质量与反应后剩余固体质量如下表所示。(假设矿石中的杂质既不和稀硫酸反应,也不溶于水)
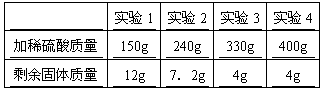
求:
(1)该矿样中Fe2O3的质量分数。
(2)所用稀硫酸的溶质质量分数。
答案
解:(1)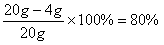
(2)设:稀硫酸的溶质质量数为x
通过实验一和实验二比较,可知4.8g三氧化二铁和90g稀硫酸恰好完全反应
Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O
160 3×98
4.8 90x
解得x=0.098=9.8%
答:该矿样中Fe2O3的质量分数为80%,所用稀硫酸的溶质质量分数为9.8% 。
