问题
计算题
生铁是铁和碳的合金。为测定某炼铁厂生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品6.0g,放入烧杯中,向其中加入65.0g稀硫酸,恰好完全反应(假设杂质不参与反应)。测得的实验数据如下:
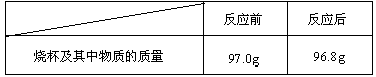
请你完成有关计算(结果保留一位小数):
(1)反应放出的氢气是多少?
(2)生铁样品的质量分数是多少?
(3)反应后所得溶液中溶质的质量分数是多少?
答案
解:(1)反应生成的氢气质量=97g-96.8g=0.2g
(2)设生铁中铁的质量为x,生成硫酸亚铁质量为y,则
Fe + H2SO4===FeSO4 + H2↑
56 152 2
x y 0.2g
x=0.2g×56/2=5.6g
y=0.2g×152/2=15.2g
Fe%=5.6/6×100%=93.3%
(3)不溶性杂质的质量=6g-5.6g=0.4g
FeSO4%=15.2/(65+6-0.4-0.2)×100%=21.6%
答:
(1)生成氢气0.2g,
(2)生铁中铁的质量分数为93.3%,
(3)反应所得溶液中FeSO4的质量分数约为21.6%。
