问题
计算题
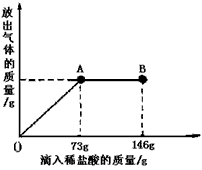
已知 Na2CO3的水溶液呈碱性。在一烧杯中盛有31.4g Na2CO3和NaCl 组成的固体混合物,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH 7(填>、=或<);
(2)通过计算求出烧杯中溶液恰好是中性时,所得溶液中溶质的质量分数。
答案
解:(1)<
(2)设固体混合物中碳酸钠的质量为x,生成氯化钠的质量为y,生成二氧化碳的质量为z
Na2CO3+2HCl===2NaCl+H2O+CO2↑
106 73 117 44
x 73g·10% y z
106:73=x:7.3g x=10.6g
73:117=7.3g:y y=11.7g
73:44=7.3g:z z=4.4g
NaCl%=(11.7g+31.4-10.6g)/(31.4g+73g-4.4g)×100%=32.5%
答:所得溶液中溶质的质量分数是32.5%。
