问题
计算题
某校化学实验课上,同学们用化学方法探究一种钢样品中铁的含量。同学们将11.4 g钢样品和20.0 g稀盐酸(足量)放入质量为120.0 g烧杯中。在化学反应过程中对烧杯及其中的剩余物进行了四次称量,记录如下表:
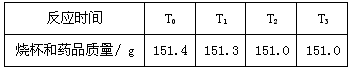
(最后结果保留一位小数)
(1)反应中产生氢气的质量是 g。
(2)钢的类型分为:

假设残留在烧杯中的黑色固体全部是碳单质,是通过计算判断这种钢属于哪类型的钢?
(3)某钢厂欲冶炼1000t这种钢材,需含氧化铁80%的赤铁矿多少吨?
答案
(1)0.4
(2)解:设钢样中含铁的质量为x
Fe + 2HCl===FeCl2 + H2 ↑
56 2
x 0.4 g
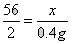 x=11.2 g
x=11.2 g
钢样含碳量= 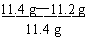 ×100% = 1.8% ,属于高碳钢
×100% = 1.8% ,属于高碳钢
(3)1000 t×(1-1.8%)÷70%÷80%=1753.6 t 或
1000t×(1-1.75%)÷70%÷80%=1754.5 t
答:需要这种赤铁矿石1753.6 t。
