问题
计算题
黄铜是铜和锌的合金(Cu-Zn),它可用来制造机器、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:(铜与盐酸不反应)
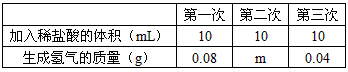
试求: (1)m= 。
(2)此黄铜样品中锌的质量分数是多少?
答案
(1)0.08
(2)解:设参加反应的锌的质量为x
生成氢气的质量:0.08g+0.08g+0.04g=0.2g
Zn+2HCl===ZnCl2+H2↑
65 2
x 0.2g
65∶2=x∶0.2g
x=6.5g
黄铜屑样品中的锌的质量分数为 6.5g/10g×100%=65%
答:黄铜样品中锌的质量分数是65%
