小明同学在某化工厂进行社会实践,技术员与小明一起分析由氯化钙和氯化钠组成的产品中氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加一定溶质质量分数为的碳酸钠溶液,记录了如图所示的曲线关系。技术员提示小明:氯化钙与碳酸钠反应的化学方程式:CaCl2+Na2CO3 ===CaCO3↓+2NaCl。求:
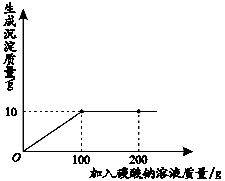
(1)当氯化钙与碳酸钠恰好完全反应时,消耗碳酸钠溶液的质量是 。
(2)计算样品中氯化钠的质量。
(3)当氯化钙与碳酸钠恰好完全反应时,过滤,所得溶液中溶质的质量分数是多少?
(1)100 g
(2)解:设样品中氯化钙的质量为x,生成氯化钠的质量为y
CaCl2+Na2CO3===CaCO3↓+2NaCl
111 100 117
x 10g y
111:x= 100:10g x=11.1g
117:y = 100:10g y=11.7g
样品中氯化钠的质量=13.4g-11.1g=2.3g
(3)所得溶液中溶质质量分数=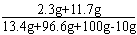 ×100%=7%
×100%=7%
