粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
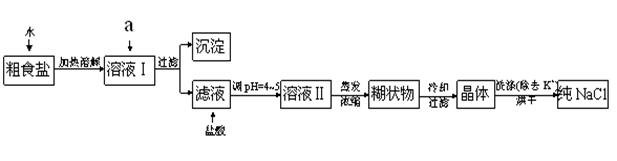
提供的试剂:饱和Na2CO3溶液、 饱和K2CO3溶液 、NaOH溶液、 KOH溶液、 BaCl2溶液 、Ba(NO3)2溶液
(1)欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的各种试剂,按滴加顺序依次为 (填化学式);
(2)蒸发浓缩溶液Ⅱ得到的糊状物的化学成分最多的是(填化学式);
(3)用提纯过的NaCl固体来配制480 mL 0.4 mol·L-1NaCl溶液时,所用仪器除烧杯、药匙、玻璃棒、天平、胶头滴管外还有 (填仪器名称);需NaCl g。
(4)电解饱和食盐水的装置如图所示:
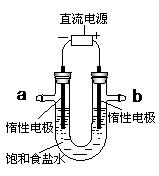
若收集到的H2为2 L,则同样条件下收集到的Cl2体积 (填“>”、“=”或“<”)2 L,其原因是: (文字描述);若将此装置的b口密封住,则电解一段时间后,U型管中可以获得一种消毒液,写出获得此消毒液的一个总反应方程式: 。
(本小题12分)
(1)滴加顺序为: BaCl2 、NaOH、Na2CO3 ;(3分,其他合理答案也可)
(2)化学成分是 NaCl (填化学式);(1分)
(3)还有 500毫升容量瓶 (2分,未答出容量瓶不给分)11.7g(2分)
(4) < 2 L,原因是: 氯气在水中有一定量的溶解 ;(各1分) 总反应方程式:NaCl+H2O→ NaClO + H2↑(条件:电解) 。(2分)
