问题
计算题
某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实 验室现有的是溶质质量分数为98%的浓硫酸。试计算:
(1)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?
(2)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?(反应的化学方程式为Zn +H2SO4===ZnSO4 + H2↑)
答案
(1)解:设加水后溶液的质量为x
10g ×98%= x×19.6%
x =50g
需要水的质量=50g-l0g =40g
(2)解:设生成氢气的质量为x
Zn+H2SO4===ZnSO4 + H2↑
98 2
20g×19. 6% x
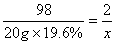 x =0. 08g
x =0. 08g
答:需要水的质量是40g,制取的氢气的质量是0.08g。
