本市脱氧剂厂生产的绿叶牌“脱氧剂”广泛用于茶叶、月饼等的保鲜,该“脱氧剂”成分为Fe粉、活性炭及少量NaCl。使用一段时间后,其中的Fe粉会转变成Fe2O3而变质。某化学兴趣小组欲探究某食品包装袋中绿叶牌“脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行如下探究过程。
步骤1:取食品包装袋中的绿叶牌“脱氧剂”一袋,将里面的固体溶于水,过滤、洗涤、干燥滤渣。
步骤2:取步骤1中的滤渣4.0 g,加入足量的稀H2SO4与滤渣充分反应,过滤、洗涤、干燥得固体0.6 g。步骤3:取步骤2中的滤液,加入足量的NaOH溶液,过滤所得固体经一系列操作,Fe元素已全部转化为
Fe2O3,其质量为4.0 g。
求:(1)4.0 g滤渣中Fe和Fe2O3两种物质的总质量。
(2)该“脱氧剂”在未变质时,Fe粉和活性炭的质量之比。
(3)该“脱氧剂”的变质程度。
解:(1)步骤2中0.6 g的固体是活性炭
4.0 g滤渣中Fe和Fe2O3两种物质的总质量为4.0 g-0.6 g = 3.4 g
(2)m(Fe)=4.0g×![]() ×100%=2.8g m(Fe):m(C)=2.8:2.6=14:3
×100%=2.8g m(Fe):m(C)=2.8:2.6=14:3
(3)由于铁变质而增加的氧元素的质量为:3.4 g-2.8 g = 0.6g
变质铁的质量为0.6 g ÷ 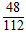 = 1.4 g
= 1.4 g
脱氧剂的变质程度=![]() ×100% = 50%
×100% = 50%
