问题
计算题
为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:

(1)写出有关反应的化学方程式
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为 时,表明合金中的锌与稀硫酸恰好完全反应。(提示:铜与稀硫酸不反应)
(3) 试计算该铜锌合金中锌的质量分数。
答案
解:(1)Zn + H2SO4===ZnSO4 + H2↑
(2)1 :5
(3)设合金中锌的质量为x,生成硫酸锌质量为y。
Zn + H2SO4 === ZnSO4 + H2↑
65 161 2
x y 0.2g
x:65=0.2g:2 x=6.5g
Zn% = 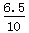 ×100% = 65%
×100% = 65%
(4)y:161=0.2g:2 y=16.1g
所得溶液中ZnSO4的质量分数: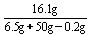 ×100%=28.6%
×100%=28.6%
