某海滨学校的一个研究性学习小组以“海洋资源与利用”为课题进行调查研究.请就他们研究中的一些问题谈谈你的观点:
(1)该学习小组提出下列利用海洋资源的建议,你认为可能实现的有______
A.海水淡化 B.海水养殖 C.海洋捕捞 D.海洋运输
(2)海水晒盐最初得到的是粗盐,含有CaCl2、MgCl2等许多杂质.经 ①溶解②沉淀 ③______(填操作名称) ④蒸发 可制得精盐.
(3)在粗盐提纯实验中有______处用到玻璃棒,其中④蒸发过程玻璃棒的作用是______.
(4)粗盐提纯实验中必须进行除杂质,该学习小组提出两个方案,其一,先加入过量的氢氧化钠,过滤后再加入稀盐酸;其二,先加入过量的碳酸钠,再加入稀盐酸.你认为______方案合理,理由是______.
(5)该学习小组建议地方政府建一化工厂,利用海水中有MgCl2,海边盛产贝壳(主要成分CaCO3),制取无水氯化镁,生产的大概流程为:
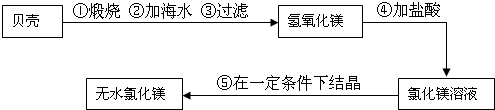
该生产过程中,没有涉及到的化学反应类型是______
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(6)以贝壳、水和纯碱为原料,经过化学反应能否制得烧碱?
若能,请写出有关反应的化学方程式;若不能,请说明理由:______.
(1)通过学习和生活经验可知ABCD是都可以实现的;
(2)要除掉不溶性杂质化学中常用过滤的方法,②步中有沉淀,故填过滤;
(3)粗盐提纯实验的步骤:溶解、过滤、蒸发,每一步中都要用到玻璃棒,溶解操作中,玻璃棒起到搅拌以加快食盐的溶解的作用;过滤操作中,玻璃棒用以引流液体;蒸发操作中,玻璃棒起到搅拌而使液体受热均匀的作用;
(4)要除掉粗盐中的CaCl2、MgCl2,若加入氢氧化钠,发生如下反应:2NaOH+MgCl2═Mg(OH)2↓+2NaCl,而氢氧化钠与氯化钙不反应,杂质除不干净;而碳酸钠与二者皆可反应生成氢氧化镁和碳酸钙沉淀,同时生成氯化钠,而过量的碳酸钠又可以通过加入过量稀盐酸的方法除去,同时又生成氯化钠,过量的稀盐酸在蒸发过程中挥发,结晶析出较为纯净的氯化钠晶体,故第二套方案好;
(5)此过程发生反应如下:
CaCO3
CaO+CO2↑;CaO+H2O=Ca(OH)2;Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2; 2HCl+Mg(OH)2═MgCl2+2H2O; 高温 .
化合反应的特点“多变一”;分解反应的特点“一变多”;复分解反应的特点是两种化合物相互交换成分,生成另外两种化合物;置换反应的特点是单质和化合物生成单质和化合物,由此可知该过程无置换反应;
(6)此题可从要制备的物质进行倒推:工业上制备烧碱的方法是用碳酸钠和氢氧化钙反应,要制氢氧化钙可用生石灰和水反应,制备生石灰可通过煅烧碳酸钙制得.
故答案为:
(1)A、B、C、D;
(2)过滤;
(3)3;搅拌,使液体受热均匀;
(4)第二套;加入氢氧化钠不能将所混杂质除尽;
(5)C;
(6)能;CaCO3
CaO+CO2↑ 高温 .
CaO+H2O=Ca(OH)2
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
