有一黑紫色的固体为KMnO4和MnO2的混合物,为测定混合物中KMnO4的质量分数,某同学取样20.0g,对固体充分加热,测得固体质量随反应时间变化的曲线见下图。
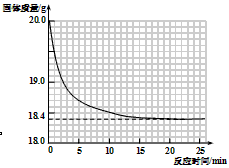
(1)生成氧气的总质量 g(精确到小数点后一位)。
(2)求样品中KMnO4的质量分数(写出计算过程)。
(3)某同学为计算反应后固体中MnO2的质量分数,计算如下:
∵已计算得到原混合物中KMnO4的质量(用“M”表示)
∴反应后固体中MnO2的质量分数=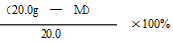
小华对上述计算过程提出了质疑,请指出其中的错误
(1)1.6
(2)解:设样品中KMnO4的质量为x
2KMnO4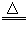 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x 1.6g
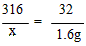
x=15.8g
故样品中KMnO4的质量分数=15.8g/20.0g×100%=79%
答:样品中KMnO4的质量分数为79%
(3)错误一:计算式分子(MnO2 的质量)没有包含高锰酸钾分解生成的MnO2的质量。
错误二:计算式分母(剩余固体质量)应为18.4g,而不是20.0g。
