问题
计算题
把12.25g氯酸钾与2g二氧化锰的混合物装入大试管中,加热制取氧气。加热一定时间后,将试管冷却、称量,由试管中得到9.45g固体物质。通过计算回答:
(1)得到的氧气在标准状况下的体积是多少升(在标准状况下,32g氧气的体积为22.4L)?
(2)氯酸钾是否已全部分解?
答案
解:得到的氧气的质量=12.25g+2g-9.45g=4.8g
得到的氧气的体积(标准状况)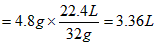
设生成4.8g氧气时需分解氯酸钾的质量为x

245 96
x 4.8g
245:x=96:4.8g x=12.25g
可见12.25g氯酸钾已全部分解
答:得到的氧气在标准状况下的体积为3.36L,12.25g氯酸钾已全部分解。
