问题
问答题
(1)海水是一种重要的自然资源.海水中含有MgCl2从海水中得到金属镁.下图是从海水中提取镁的简单流程.
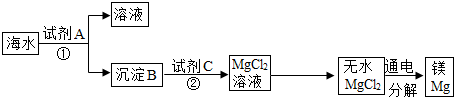
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为______,由无水MgCl2制取Mg的化学方程式为______.
(2)海水“制碱”.下图是海水“制碱”的部分简单流程.
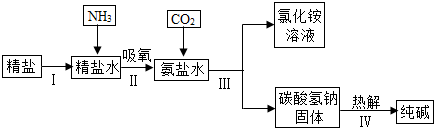
步骤Ⅲ反应的化学方程式为:______,在流程中能够回收再利用的物质有水和______.制氨盐水的过程中要先通入氨气,再通入二氧化碳.如果反过来,二氧化碳的吸收率会降低.这是因为______.
答案
(1)由沉淀B与试剂C发生的是中和反应,得到MgCl2;可知,沉淀B是Mg(OH)2;根据反应条件,由无水MgCl2制取Mg的化学方程式为:MgCl2
Mg+Cl2↑; 通电 .
(2)已知二氧化碳和氨盐水反应,生成氯化铵溶液和碳酸氢钠,方程式为:NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3;在流程中能够回收再利用的物质有水和CO2;因为氨气的水溶液是碱性,更易吸收二氧化碳,所以制氨盐水的过程中要先通入氨气,再通入二氧化碳.
故答案为:(1)Mg(OH)2;MgCl2
Mg+Cl2↑. 通电 .
(2)NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3;CO2;氨气的水溶液是碱性,更易吸收二氧化碳.
