问题
计算题
在100mL稀盐酸中加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出。下图是加入粉末的质量与产生CO2(该状况下,气体的密度为1.964 g / L)体积的关系。请计算:

(1)该盐酸中HCl的质量。
(2)若该盐酸为120mL时,加入粉末为58.5g,求产生CO2的体积。
(3)若粉末的质量为xg,该盐酸的体积为140mL,产生的CO2体积为yL。试写出粉末质量x(g)与产生CO2体积y(L)之间的关系。
答案
解:(1)m(CO2) =11.2×1.964 =22g
设盐酸中HCl的质量为x。
HCl ~ CO2
36.5 44
x 22g
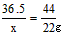
x=18.25g
(2)∵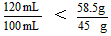
∴ V(CO2) =11.2×1.2=13.44L
(3)m(粉末) =45×1.4 =63g
若x ≤ 63 g ,则y=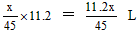
若x > 63 g ,则y=11.2×1.4=15.68 L
答:该盐酸中HCl的质量为18.25g;产生CO2的体积为13.44 L;若x≤63 g ,y=(11.2x/45)L,若x>63 g,y=15.68 L 。
