为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表。

(1)计算该铜锌合金中锌的质量分数。
(2)计算所用稀硫酸中溶质的质量分数。(结果精确到0.1%)
(可能用到的相对原子质量H―1 O―16 S―32 Cu-64 Zn―65)
(1)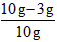 ×100%=70%
×100%=70%
(2)50g稀硫酸与10g该合金反应时,有6.5g锌参加反应,锌有剩余,而硫酸完全反应。设50g稀硫酸中硫酸的质量为x。
Zn+H2SO4==ZnSO4+H2↑
65 98
6.5g x
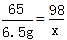
x=9.8 g

答:该铜锌合金中锌的质量分数为70% ;稀硫酸中硫酸的质量分数为19.6% 。

 ,岁中积粟三百万。知益州,秦民与夷落数千人列奎治状,请留,玺书褒谕,不许。成都民妇讼其子不孝,诘之,乃曰:“贫无以为养。”奎出俸钱与之,戒曰:“若复失养,吾不贷汝矣!”其母子遂如初。尝夜宴,有戍卒杀人,人皆奔走,奎密遣捕杀之,坐客莫有知者。临事持重明决,多此类也。
,岁中积粟三百万。知益州,秦民与夷落数千人列奎治状,请留,玺书褒谕,不许。成都民妇讼其子不孝,诘之,乃曰:“贫无以为养。”奎出俸钱与之,戒曰:“若复失养,吾不贷汝矣!”其母子遂如初。尝夜宴,有戍卒杀人,人皆奔走,奎密遣捕杀之,坐客莫有知者。临事持重明决,多此类也。