含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物.回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移方向和数目:______.
(2)Ba2+有剧毒.某市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将碳酸钡当作干粉使用,导致多人食用烧饼后中毒.试写出碳酸钡与胃酸(以盐酸表示)反应的离子反应方程式______.
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面______,则发生了钝化;若铁棒表面______,则未发生反应.
(4)用Na2SO3吸收法作为治理SO2污染的一种方法,其原理为(用化学方程式表示):______.
(5)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.该反应的化学方程式:______.
(6)制取硫酸铜有两种方法:方法一:2Cu+O2
2CuO,CuO+H2SO4═CuSO4+H2O, △ .
方法二:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,方法一与方法二相比,其优点是:______(答任一点). △ .
(1)亚硫酸被氧气氧化生成硫酸,根据电子转移守恒配平后,标出电子转移数目与方向为
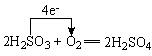
,
故答案为:
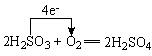
;
(2)碳酸钡与盐酸反应生成氯化钡、二氧化碳与水,反应离子方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O,
故答案为:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)钝化是在金属表面生成一层致密的氧化物保护膜,阻止内部进行进行反应,若发生钝化,则氧化镁保护膜阻止Fe与硫酸铜反应,无明显现象,否则发生反应,会有紫红色的铜析出,
故答案为:无明显现象;有紫红色物质析出;
(4)亚硫酸钠与二氧化硫、水反应生成亚硫酸钠,反应方程式为:Na2SO3+SO2+H2O=2NaHSO3,
故答案为:Na2SO3+SO2+H2O=2NaHSO3;
(5)用CO还原SO2得到单质硫,根据电子转移守恒可知,碳元素被氧化生成二氧化碳,反应方程式为:SO2+2CO
S+2CO2, 一定条件 .
故答案为:SO2+2CO
S+2CO2; 一定条件 .
(6)方法一与方法二相比,硫酸的用量较少,没有二氧化硫生成、无污染,
故答案为:节省原料(硫酸用量少)、无污染.
