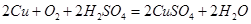(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下图所示实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)步骤I、II、III中均需进行的实验操作是 。
(2)溶液D中的离子主要有 ;试剂X是 。
(3)进行步骤II时,该小组用右图装置及试剂将制得的CO2通入溶液A中,一段时间后,观察到烧杯中产生的Al(OH)3沉淀逐渐减少,其原因是 (用离子方程式表示);为了避免Al(OH)3沉淀减少,根据右图所示,改进的措施是 。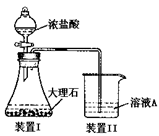
(4)从氧化还原反应和环保角度考虑,用F制备CuSO4时需要氧气和硫酸共同参与,对应的化学方程式是 。
(12分)(1)过滤 (2)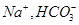 ; 稀硫酸
; 稀硫酸
(3)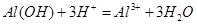 ; 在装置I、II之间增加一个盛有饱和
; 在装置I、II之间增加一个盛有饱和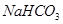 溶液的洗气瓶
溶液的洗气瓶
(4)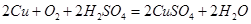
合金中只有铝可溶与NaOH溶液:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,经过滤得到固体B:铁与铜,而溶液A为NaAlO2及过量的NaOH混合溶液;
往溶液A中通入足量的CO2气体:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3;NaOH+CO2=NaHCO3,过滤后滤液D的成分主要为NaHCO3溶液;
固体B(铁与铜)最终均要转化为硫酸盐,故试剂X为稀硫酸:Fe+H2SO4=FeSO4+H2↑,过滤后得到固体F:铜
(1)步骤I、II、III均是将不溶物与液体分离,为过滤操作
(2)滤液D为NaHCO3溶液,所含离子为: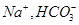 ,试剂X是稀硫酸
,试剂X是稀硫酸
(3)浓盐酸易挥发,制取的CO2气体中混有HCl,故: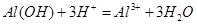 ;为了除去CO2气体中混有HCl,最好用碳酸的酸式盐,例如NaHCO3溶液:在装置I、II之间增加一个盛有饱和
;为了除去CO2气体中混有HCl,最好用碳酸的酸式盐,例如NaHCO3溶液:在装置I、II之间增加一个盛有饱和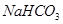 溶液的洗气瓶
溶液的洗气瓶
(4)