问题
计算题
生铁和钢都是合金,钢中碳的含量在0.03%~2.0%之间,生铁中碳的含量在2.0%~4.3%之间。将一块质量为9.00g的铁合金放入锥形瓶中,再向锥形瓶中加入100g稀硫酸,恰好使铁合金中的铁完全反应(碳不溶于稀硫酸;铁合金中其它元素含量很低,可忽略不计),测得生成氢气的体积为3.50L(氢气在该条件下的密度为0.0880g/L)。试计算回答:(计算结果保留三位有效数字)
(1) 生成氢气的质量。
(2) 该铁合金中含铁的质量。
答案
(1)氢气的质量为:3.50L×0.0880g∕L=0.308g
(2)解:设含铁的质量为x
Fe + H2SO4===FeSO4 +H2↑
56 2
x 0.308g
56:x=2:0.308g
x=8.624g
该铁合金中碳元素的质量分数为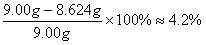
∵4.2%介于2.0%~4.3%之间
∴该铁合金是生铁。
