(8分)实验室有 NaHSO4 ,Ba(OH)2, NH3 • H2O NaHCO3、KAl(SO4)2五种无色溶液,现欲通过它们之间的相互反应现象对其进行鉴别。部分物质间的反应现象如下表:

表中“ ”表示生成气体物质,“
”表示生成气体物质,“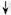 ”表示生成沉淀。
”表示生成沉淀。
根据以上信息,回答以下问题:
(1)B、E的化学式分别为_______、___________;
(2) 写出A的电离方程式___________________________:;
(3) C、D两溶液反应的离子方程式为___________________________;
(4) 向含有0.1 mol溶质的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为_________mol。
(8分)(1)NaHSO4、Ba(OH)2 (2分) (2)NH3·H2O NH4++OH-(2分)
NH4++OH-(2分)
(3)Al3++3HCO3-= Al(OH)3↓+3CO2↑(2分) (4) 0.25 (2分)
本题考查物质检验和推断。解题的关键是找到突破点——既产生沉淀又产生气体的两种物质是NaHCO3、KAl(SO4)2,能发生双水解反应生成Al(OH)3沉淀和CO2气体,结合图表,C只能与另一种物质产生沉淀,故C为NaHCO3,E为Ba(OH)2,D为KAl(SO4)2,与NaHCO3产生气体的只有另一种物质NaHSO4,故B为NaHSO4,NH3 • H2O只能与KAl(SO4)2产生沉淀,故A为NH3 • H2O,综上所述,A、B、C、D、E分别为NH3 • H2O、NaHSO4、NaHCO3、KAl(SO4)2、Ba(OH)2。(1) B、E的化学式分别为NaHSO4、Ba(OH)2(2)NH3 • H2O是弱电解质,部分电离,电离方程式为NH3·H2O NH4++OH-。(3) NaHCO3、KAl(SO4)2发生双水解反应生成Al(OH)3沉淀和CO2气体,反应的离子方程式为Al3++3HCO3-= Al(OH)3↓+3CO2↑。(4) 0.1 mol溶质的KAl(SO4)2溶液滴加Ba(OH)2溶液,当Al3+全部沉淀时,沉淀量最大,产生0.1molAl(OH)3沉淀和0.15molBaSO4,故所生成沉淀的物质的量之和最多为0.25mol。
NH4++OH-。(3) NaHCO3、KAl(SO4)2发生双水解反应生成Al(OH)3沉淀和CO2气体,反应的离子方程式为Al3++3HCO3-= Al(OH)3↓+3CO2↑。(4) 0.1 mol溶质的KAl(SO4)2溶液滴加Ba(OH)2溶液,当Al3+全部沉淀时,沉淀量最大,产生0.1molAl(OH)3沉淀和0.15molBaSO4,故所生成沉淀的物质的量之和最多为0.25mol。

 ”和“
”和“ ”表示两种不同的原子,下列说法正确的是( )
”表示两种不同的原子,下列说法正确的是( )