(1)铁是人体必需的微量元素,目前市售补铁制品较多,为保护消费者的利益,质检部门需对补铁剂中铁的含量做进一步测定。
①将补铁剂中的Fe2+氧化成Fe3+,结合你所选的氧化剂写出相关的离子方程式:____。
②将Fe3+用氨水沉淀为不溶于水的氢氧化铁,试写出发生反应的离子方程式:____。
③举出一种检验Fe3+的化学试剂(所选试剂不能是碱类物质)和相关的实验现象___ 。
(2)生铁是一种铁合金,下面的实验可以粗略测定生铁样品的含碳量。把生铁高温灼烧,生铁中的碳和硫转化成CO2和SO2(SO2可以被KMnO4溶液吸收)气体,将气体通入下列装置:装置中盛放的溶液可从下列4种试剂中选择(每种试剂只能用一次)
①澄清石灰水②KMnO4 ③品红④浓H2SO4
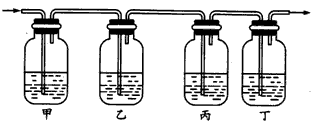
那么,根据实验的需要,甲、乙、丙、丁四个瓶盛放的试剂依次最好是(填编号)___。
(3)高温条件下若将水蒸气通入铁粉中,发生反应的化学方程式是:___。
(4) SO2是一种大气污染物,向大气中过量排放SO2将会形成酸雨污染。正常雨水pH约为_____。 (填“5.6”“7.0”或“8.4”)。为了防止污染,工厂收集排出的SO2并与空气反应合成三氧化硫,写出反应的化学方程式____。 三氧化硫通入浓氨水,可得到一种肥料,写出反应的化学方程式___。
(1)①2Fe2++Cl2=2Fe3++2Cl-
②Fe3++ 3NH3·H2O=Fe(OH)3↓+3NH4+
③向待测液中滴加KSCN溶液,若出现血红色就说明有Fe3+
(2)②③④①
(3)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(4) 5.6 ;2SO2+O2 2SO3 ;SO3+2NH3·H2O=(NH4)2SO4+H2O
2SO3 ;SO3+2NH3·H2O=(NH4)2SO4+H2O
