问题
计算题
小军同学采集了一些生铁样品(含杂质,杂质不溶于水,不与稀硫酸反应),采用如左图所示装置进行分析。分别称得锥形瓶与棉花的质量为44.1g,生铁样品的质量为9.0g。在锥形瓶中加入足量稀硫酸后,立即开始记录电子天平的示数,记录数据如右图所示。
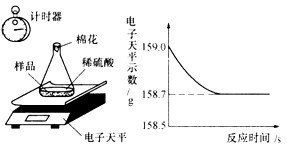
请认真分析数据,回答下列问题:
(1)小军数据处理的下列图像中正确的是__________。
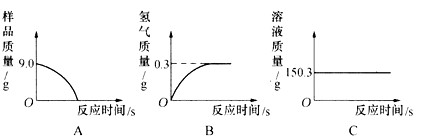
(2)计算样品中铁的质量分数(请写明过程)。
(3)计算反应后所得溶液中硫酸哑铁的质量分数(请写明过程)。
答案
(1)B
(2)解:设反应的铁的质量为x,生成的硫酸亚铁的质量为y。
Fe+H2SO4==FeSO4+H2↑
56 152 2
x y 0.3g
得出x=8.4g,铁的质量分数为8.4g/9g= 93. 3%
y=22.8g
(3)硫酸亚铁的溶质质量分数为22.8g/(8.4g+159.0g-9.0g-44.lg-0.3g)×100%=20%