问题
计算题
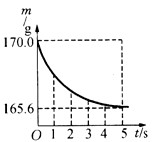
在盛有10.0g氯化钠和碳酸氢钠固体混合物的锥形瓶中,加入143.4g稀盐酸,恰好完全反应,用仪器测得锥形瓶连同药品的总质量(m)与反应时间(t)的关系如下图所示。
试求:
(1)原混合物中氯化钠的质量。
(2)稀盐酸中溶质HCl的质量。
(3)反应后所得溶液的溶质质量分数。
答案
解:
(1)设原混合物中碳酸氢钠的质量为x,稀盐酸中溶质HCl的质量为y,生成的氯化钠质量为z。
产生CO2气体的质量:170.0g-165.6g=4.4g
NaHCO3+HCl==NaCl+H2O+CO2↑
84 36.5 58.5 44
x y z 4.4g
84/44=x/4.4g
x=8.4g
原混合物中NaCl的质量为10.0g-8.4g=l.6g。
(2)36.5/44=y/4.4g
y=3.65g
(3)58.5/44=z/4.4g
z=5.85g
NaCl的总质量为1.6g+5.85g=7.45g。
反应后溶液的总质量为10.0g+143.4g-4.4g=149g。
反应后溶液中溶质的质量分数为(7.45g/149g)×100%=5%。