问题
计算题
甲、乙、丙三位同学用下列试剂分别进行实验,所取试剂用量如下表所示,且反应均恰好完全。

已知:A1+A2+A3=23.0g,B1+B2+B3=219.0g,现将甲、乙、丙三位同学所得到的溶液倒入同一容器中,所得溶液总质量为237.6g。求:
(1)丙同学所取CaCO3固体的质量;
(2)最终所得混合溶液中溶质的质量分数。
答案
解:(1)设丙同学所取CaCO3固体的质量为x
反应生成二氧化碳的质量为:23.0g+219.0g-237.6g=4.4g
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 4.4g
x= 10.0g
(2)因为都是恰好完全反应,所以溶液中的溶质是CaCl2,且CaCl2的质量可由氯元素在反应前、后守恒计算得出
设反应共生成CaCl2的质量为y
2HCl ~ CaCl2
73 111
219g×10% y
y =33.3g
CaCl2的质量分数: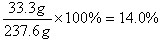
答:(1)丙同学所取CaCO3固体的质量为10.0g;
(2)最终所得混合溶液中溶质的质量分数为14.0%。
