(8分)I、通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 7.6 | 2.7 | 5.7 | 4.7 |
| 完全沉淀时的pH | 9.7 | 3.7 | 8.5 | 7.3 |
(2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:

|
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是
(填化学式)。
II、重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol·L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
a、NaOH b、Na2S c、KI d、Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
Ⅰ、(1)Cu2++2e= Cu 阳极 (2)①d, 将Fe2+氧化为Fe3+ ②过滤,Fe2+
Ⅱ(1)b (2)c(Pb2+)=1.2×10-3mol/L
Ⅰ、(1)精炼铜时,阴极得到电子,即溶液中的铜离子得到电子而析出铜,方程式为Cu2++2e= Cu。粗铜中的金或银,在电解过程中不失去电子,沉积在阳极的槽底,析出阳极泥。
(2)①氢氧化亚铁沉淀的pH大于氢氧化铜的,所以需要将亚铜离子氧化生成铁离子,然后通过控制pH将氢氧化铁沉淀而除去。由于不能引入新的杂质,双氧水的还原产物使是水,所以答案选d。
②氢氧化铁难溶于水,过滤即可。
Ⅱ(1)根据溶度积常数可知,硫化银和硫化铅放热溶度积常数最小,所以选择硫化钠最好,答案选b。
(2)溶液pH=8,则OH-浓度是10-6mol/L,则根据氢氧化铅的溶度积常数可知,处理后的废水中c(Pb2+)=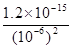 =1.2×10-3mol/L。
=1.2×10-3mol/L。
