问题
计算题
为探究一种混合物是由铜粉与镁粉、铁粉、锌粉中的哪一种金属组成。某同学进行了如下实验:称量8.0g该混合物粉末放入烧杯中→将140g14%的稀硫酸平均分成四份依次加入该烧杯中→充分反应后测定剩余固体质量→数据处理:将测得剩余固体质量与加入稀硫酸的质量关系绘制成下图。
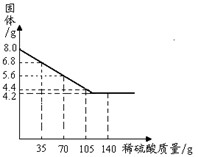
试计算:
⑴该混合物是由铜粉和____组成的。
⑵加入105g稀硫酸充分反应后,所得溶液的质量。
答案
解:⑴镁粉
⑵设生成氢气的质量为x。
Mg+H2SO4==MgSO4+H2↑
24 2
8.0g-4.4g x
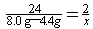
x=0.3g
所得溶液的质量:(8.0g-4.4g)+105g-0.3g=108.3g
