问题
计算题
有一包固体粉末,可能是CaCO3、Na2SO4、CuSO4、Na2CO3中的一种或多种。为确定原固体粉末的组成,该实验小组同学先用托盘天平称取46.2g该粉末,溶于水配成174.6g溶液,再往其中加入溶质质量分数为8%的NaOH溶液,发生如下反应:CuSO4+2NaOH==Na2SO4+Cu(OH)2↓,产生沉淀的质量与所加NaOH溶液质量的关系如图所示。据图回答:(结果保留小数点后一位)
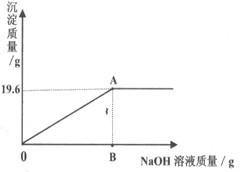
(1)计算产生最大沉淀量时所加NaOH溶液的质量。
(2)通过计算确定46.2g固体粉末的组成。(回答出物质名称和其质量)
(3)计算A点所示溶液中溶质的质量分数。
答案
(1)解:设生成最大沉淀量时所加NaOH的质量为x;46.2g粉末中含有CuSO4的质量为y;生成Na2SO4的质量为z。
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
160 80 142 98
y x z 19.6g
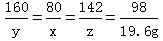
x=16.0g
那么NaOH溶液的质量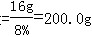
y=32.0g;z=28.4g
(2)Na2SO4的质量=46.2g-32g=14.2g
则46.2g固体粉末由14.2gNa2SO4和32.0gCuSO4组成。
(3)Na2SO4的质量分数=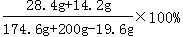 =12.0%
=12.0%
