问题
计算题
某小组利用实验数据,求算金属M的相对原子质量。已知金属M和硫酸反应的化学方程式为:M+H2SO4==MSO4+H2↑。现取20g该金属样品于烧杯中,然后向其中加入稀硫酸,实验数据记录如下:

第5次实验后,烧杯中还有0.5g剩余固体。计算该金属的相对原子质量。
答案
解:20g该金属样品中最后还有0.5g剩余固体不能参加反应,参加反应的金属质量=20g-0.5g=19.5g
生成氢气的质量500g+20g-519.4g=0.6g
设该金属的相对原子质量为x。
M+H2SO4==MSO4+H2↑
x 2
19.5g 0.6g
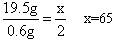
答:该金属的相对原子质量为65。
