目前测定空气中SO2含量主要用氧化还原反应.已知SO2气体与酸性KMnO4溶液反应时,MnO4- 被还原为Mn2+,SO2被氧化成SO42-.
为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如图所示的实验装置:

①其中:

或

表示密闭容器;
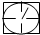
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
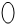
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;→表示气体的流向.
②酸性KMnO4溶液体积为200mL,浓度为0.1mol•L-1.回答下列问题:
(1)配制200mL0.1mol•L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有______、玻璃棒、______、______、______.玻璃棒的作用是______.
(2)写出并配平测定SO2含量的离子方程式:______
(3)若气体流速管中气体流速为acm3/min,当tmin时酸性KMnO4溶液恰好褪色,则空气中SO2的含量为______(g/cm3).
(4)实验中棉花的作用是______;
若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是______
(5)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):______.
(1)配制200mL0.1mol•L-1酸性KMnO4溶液,由于实验室没有200mL容量瓶,应用250mL容量瓶配制,需用托盘天平称量高锰酸钾固体,在烧杯中加水溶解并用玻璃棒搅拌,冷却后用玻璃棒转移至容量瓶中,玻璃棒的作用是引流,加水至溶液离刻度线1~2cm时改用胶头滴管滴加至刻度线,
故答案为:天平;烧杯;250mL容量瓶;胶头滴管;搅拌和引流;
(2)SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,
反应的方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(3)高锰酸钾的物质的量为0.2L×0.1moL/L=0.02moL,
根据反应方程式5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,
可知atml空气中含有SO2的物质的量为
×0.02mol=0.05mol,5 2
质量为0.05mol×64g/moL=3.2g,
所以空气中SO2的含量为
g/cm3,3.2 at
故答案为:
;3.2 at
(4)棉花具有吸附性,可吸收气流中的颗粒,防止可吸入颗粒堵塞导气管或进入酸性高锰酸钾溶液中,使测量质量不准,若要测定空气中可吸入颗粒的含量(g/L),还需要测出的数据是吸收前后颗粒吸附剂、棉花、盛放容器的总质量,
故答案为:防止可吸入颗粒堵塞导气管或进入酸性高锰酸钾溶液中,使测量质量不准;吸收前后颗粒吸附剂、棉花、盛放容器的总质量(或将装置用编号表示回答,或答颗粒吸附剂、棉花、盛放容器的总质量的增加值);
(5)如测得的数值总是比实际含量偏低,说明二氧化硫未和酸性高锰酸钾溶液充分反应,可能原因是气流速率过快,
故答案为:通入气流速率过快,二氧化硫未和酸性高锰酸钾溶液充分反应就已经被排出;
