用如下装置可以完成一系列实验(图中夹持装置已略去).
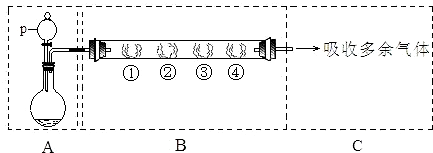
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | ______ | ______ | 褪色 | 浅黄色 |
| 体现SO2的性质 | ______ | ______ | ______ | ______ |
(1)p中盛装试剂为______.
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式______.①处包有的某固体物质可能是______.
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在整个实验过程中,在③处能观察到______.
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:______.
Ⅰ.SO2可溶于水生成亚硫酸(H2SO3),H2SO3显酸性,能使石蕊试液变红;
SO2具有漂白性,能使品红溶液褪色;
碘能使淀粉溶液变蓝,SO2具有还原性,能与碘水反应:SO2+I2+2H2O=H2SO4+2HI,溶液蓝色褪去;
SO2具有氧化性,能与氢硫酸反应:SO2+2H2S=3S+2H2O,
故答案为:
| 溶液变红 | 溶液褪色 | |||
| 水溶液显酸性 | 漂白性 | 还原性 | 氧化性 |
(2)有棕黄色物质确定为单质碘,卤素单质间能发生置换反应:Cl2+2KI=2KCl+I2,因通过①后生成了Cl2,而KMnO4溶液能氧化HCl得到Cl2,所以某固体物质可能是KMnO4,故答案为:Cl2+2I-=2Cl-+I2;b;
(3)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,故答案为:先变红后褪色;
(4)②处有棕黄色褪去,生成无色的IO3-,碘的化合价升高,则氯元素和化合价降低为-1价,化学方程式为:
5Cl2+I2+6H2O=2HIO3+10HCl,离子方程式为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-,
故答案为:5Cl2+I2+6H2O=12H++2IO3-+10Cl-.
