问题
计算题
为测定某黄铜样品中锌的含量,某同学称取20g黄铜(铜和锌的合金)样品于烧杯中,向其中加入稀硫酸至不再产生气泡为止,共消耗100g质量分数为9.8%的稀硫酸,请计算:
(1)该黄铜样品中锌的质量。
(2)反应后所得溶液的溶质质量分数(计算结果保留0.1%)。
答案
解:100g9.8%的稀硫酸中含纯硫酸的质量为:100g×9.8%==9.8g
设黄铜样品中锌的质量为x,生成硫酸锌的质量为y,充分反应后生成氢气质量为z。
Zn+H2SO4==ZnSO4+H2↑
65 98 161 2
x 9.8g y z
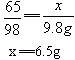
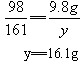
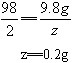
反应后所得溶液的溶质的质量分数为: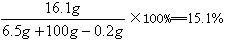
答:黄铜样品中锌的质量为6.5g,反应后所得溶液的溶质的质量分数为15.1%。
