(14分)在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~100nm之间)。下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。
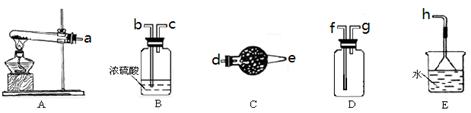
(1)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选 填字母):a接 , 接 , 接h ;用A装置制取NH3的化学反应方程式为 。
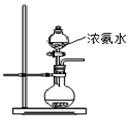
(2)用图所示装置也可以制取NH3,则圆底烧瓶中的固体可以选用 (选填字母编号);
A.碱石灰
B.生石灰
C.无水氯化钙
D.无水硫酸铜E.烧碱
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是 ,试写出制纳米级碳酸钙的化学方程式 ;
(4)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级 。
(1)d e g f(2分)2NH4Cl+Ca(OH)2 CaCl2 + 2NH3 ↑+ H2O(其它答案合理也给分)(2分)
CaCl2 + 2NH3 ↑+ H2O(其它答案合理也给分)(2分)
(2)ABE(3分漏选一个扣1分,错选一个倒扣1分)
(3)NH3(2分) CaCl2 + CO2 + 2NH3 + H2O=CaCO3↓ + 2NH4Cl(2分)
(4)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是(3分)
(1)实验室用熟石灰和氯化铵加热制取氨气,所以A是发生装置,反应的方程式为2NH4Cl+Ca(OH)2 CaCl2 + 2NH3 ↑+ H2O。氨气是碱性气体,应该用碱石灰干燥氨气,不能用浓硫酸。氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,所以连接顺序是d e g f。
CaCl2 + 2NH3 ↑+ H2O。氨气是碱性气体,应该用碱石灰干燥氨气,不能用浓硫酸。氨气的密度小于空气的,且氨气极易溶于水,所以应该用向下排空气法收集,所以连接顺序是d e g f。
(2)氨水中存在平衡NH3+H2O NH3·H2O
NH3·H2O NH4++OH-,所以要制取氨气,就应该时平衡向逆反应方向移动,所以答案选ABE。
NH4++OH-,所以要制取氨气,就应该时平衡向逆反应方向移动,所以答案选ABE。
(3)CO2在水溶液中的溶解度小,而氨气极易溶于水,所以首先通入的是氨气,反应的方程式为CaCl2 + CO2 + 2NH3 + H2O=CaCO3↓ + 2NH4Cl。
(4)由于微粒的直径是纳米级的,所以形成的分散性应该是胶体,鉴别胶体可以用丁达尔效应。即取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级碳酸钙,否则不是。
