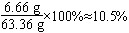问题
计算题
为了测定某种石灰石中碳酸钙的质量分数,取5g石灰石样品放入烧杯中,将60g稀盐酸分成四次加入烧杯中,充分反应后,测得实验数据如下表(样品中的杂质不与盐酸反应也不溶于水):
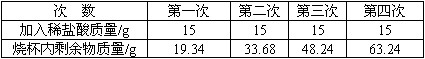
请你分析并进行有关计算:
(1)哪几次反应后,盐酸有剩余_____________。
(2)石灰石样品中碳酸钙的质量分数。
(3)上述实验结束后,向烧杯内的物质中加入石灰石至不再产生气泡,过滤。求滤液中溶质的质量分数。(结果精确到0.1%)
答案
(1)三、四
(2)解:设5g石灰石中CaCO3的质量为x。
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 44
x 1.76g
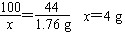

(3)设60g盐酸完全反应需CaCO3质量为y,生成的CaCl2质量为z, * * 生CO2质量为m。

(或计算出第一次参加反应的CaCO3质量是1.5g。1.5g×4=6g或通过第一次反应计算出盐酸中溶质质量分数为7.3%)
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 111 44
y z 2.64g

滤液质量:6g+60g-2.64g=63.36g