某学生在课外活动中用铁粉(含杂质且杂质不参加反应)和稀硫酸反应制取氢气。所做5次实验结果记录如下表(每次实验产生的氢气全部被收集,且体积在相同条件下测定。该条件下氢气的密度是0.089/L):
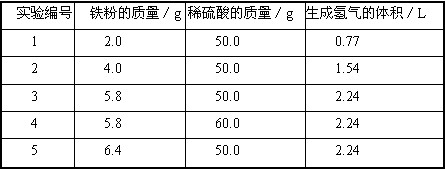
根据上述实验结果进行分析、计算,并回答下列问题:
(1)上述实验中,铁粉一定过量的实验编号是_________;
(2)铁粉的纯度是________;
(3)计算稀硫酸的质量分数(要求写出计算过程,计算结果精确到0.1)。
(1)5
(2)96.5%
(3)解:根据表中所给数据分析,确定3组实验恰好完全反应
设生成2.24L氢气需H2SO4的质量为m。
Fe+H2SO4==FeSO4+H2↑
98 2
m 2.24L×0.089g/L
98/m=2/(2.24L×0.089g/L)
m=9.8g
稀硫酸的质量分数=9.8g/50g×l00%=19.6%
答:稀硫酸的质量分数是19.6%。




