问题
计算题
小雨从超市买同一包纯碱,其包装说明如图1所示。他称取了11g纯碱样品溶于水中配制成50g溶液,然后向溶液中滴加氯化钙溶液,其产生沉淀的质量与滴加氯化钙溶液的质量关系如图2所示。
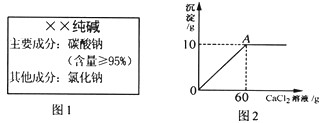
(1)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。
(2)计算A点时,所用溶液中溶质的质量分数。(计算结果保留一位小数)
答案
解:设样品中碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3+CaCl2==CaCO3↓+2NaCl
106 100 117
x 10g y
106/x=100/10g
x=10.6g
117/y=100/l0g y=11.7g
(1)样品中碳酸钠的质量分数为:(10.6g/11g)×100%=96.4%>95%
所以纯碱样品中碳酸钠的质量分数与包装说明相符。
(2)A点时,所得溶液中溶质的质量为:11.7g+(11g-10.6g)=12.1g
A点时,所得溶液中溶液的质量为:50g+60g-l0g=100g
A点时,所得溶液中溶液的质量分数为:(12.1g/l00g)×100%=12.1%
答:(1)纯碱样品中碳酸钠的质量分数与包装说明相符。
(2) 纯碱样品中碳酸钠的质量分数与包装说明相符12.1%