二氧化碳碳捕获与封存技术(CCS)可以减少化石燃料燃烧以及其他工业用途的二氧化碳排放量,从而有助于减少温室气体的排放.该技术引起了各国的普遍重视.
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
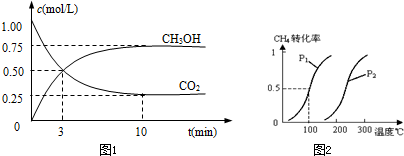
①从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/(L•min).
②下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)⇌CO(g)+3H2(g)△H1;②CO(g)+2H2(g)⇌CH3OH(g)△H2
将0.20molCH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率______(填“增大”、“减小”或“不变”),平衡向______方向移动.
(2)反应①的△H1______0(填“<”、“=”或“>”),其平衡常数表达式为K=______,压强为P1,100℃时的平衡常数值是______.
Ⅰ.①由图可知,10min到达平衡,平衡时甲醇的浓度变化为0.75mol/L,故v(CH3OH)=
=0.075mol/(L.min),速率之比等于化学计量数之比,故v(H2)=3v(CH3OH)=0.075mol/(L.min)×3=0.225mol/(L.mon),0.75mol/L 10min
故答案为:0.225;
②使n(CH3OH)/n(CO2)增大,应采取措施,使平衡向正反应移动,但不能只增大二氧化碳或降低甲醇的量,
A.该反应正反应是放热反应,升高温度平衡向逆反应移动,n(CH3OH)/n(CO2)减小,故A错误,
B.充入He(g),使体系压强增大,容器的容积不变,反应混合物的浓度不变,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误,
C.将H2O(g)从体系中分离,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故C正确,
D.再充入1molCO2和3molH2,等效为增大压强,平衡向正反应移动,n(CH3OH)/n(CO2)增大,故D正确;
故答案为:CD;
Ⅱ.(1)温度不变,增大压强,反应速率增大,正反应为气体体积增大的反应,平衡向逆反应方向移动,
故答案为:增大;逆反应;
(2)由图可知,反应①温度越高甲烷的转化率越大,说明升高温度平衡向正反应方向移动,故正反应为吸热反应,即△H1>0;
CH4(g)+H2O(g)⇌CO(g)+3H2(g)的平衡常数k=
;c(CO)•c3(H2) c(CH4)•c(H2O)
甲烷的起始浓度=
=0.02mol/L,水蒸气起始浓度=0.2mol 10L
=0.03mol/L,由图可知,100℃到达平衡时甲烷的转化率为0.5,故甲烷的浓度变化量为0.01mol/L,则:0.3mol 10L
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
开始(mol/L):0.02 0.03 0 0
变化(mol/L):0.01 0.01 0.01 0.03
平衡(mol/L):0.01 0.02 0.01 0.03
故100℃时该反应平衡常数k=
=1.35×10-3,0.01×0.033 0.01×0.02
故答案为:>;
;1.35×10-3.c(CO)•c3(H2) c(CH4)•c(H2O)
